
APLICACIONES DE LA TERMODINAMICA




 bjeto más "caliente" tendrá una temperatura mayor. Físicamente es una magnitud escalar relacionada con la energía interna de un sistema termodinámico. Más específicamente, está relacionada directamente con la parte de la energía interna conocida como "energía sensible", que es la energía asociada a los movi mientos de las partículas del sistema, sea en un sentido traslacional, rotacional, o en forma de vibraciones. A medida que es mayor la energía sensible de un sistema se observa que esta más "caliente" es decir, que su temperatura es mayor.
bjeto más "caliente" tendrá una temperatura mayor. Físicamente es una magnitud escalar relacionada con la energía interna de un sistema termodinámico. Más específicamente, está relacionada directamente con la parte de la energía interna conocida como "energía sensible", que es la energía asociada a los movi mientos de las partículas del sistema, sea en un sentido traslacional, rotacional, o en forma de vibraciones. A medida que es mayor la energía sensible de un sistema se observa que esta más "caliente" es decir, que su temperatura es mayor.
ESCALA ABSOLUTA
Se llama escala absoluta porque a los cero kelvin encontramos la menor temperatura teóricamente posible, no existen temperaturas negativas en kelvin. La tercera Ley de la Termodinámica establece que a esta temperatura los cristales perfectos de todos los elementos y compuestos tienen entropía cero. O bien a esta temperatura la materia tiene cero energía interna, por lo tanto más fría no podría estar. Es un límite inferior para la temperatura. Cero grados kelvin equivale a 273.15 grados centígrados bajo cero, y la teoría involucrada en la Tercera Ley de la Termodinámica establece que el cero absoluto es imposible de alcanzar porque implicaría que incluso los electrones dejaran de moverse lo cual entra en contradicciones con otras teorías acerca de la estructura atómica.
CALOR
El calor es posible definirlo como energía transferida entre dos cuerpos o sistemas, se puede asociar al movimiento de los átomos, moléculas y otras partículas que forman la materia. El calor puede ser generado por reacciones químicas (como en la combustión), reacciones nucleares (como en la fusión nuclear de los átomos de hidrógeno que tienen lugar en el interior del Sol), disipación electromagnética (como en los hornos de microondas) o por disipación mecánica (fricción). Su concepto está ligado al Principio Cero de la Termodinámica, según el cual dos cuerpos en contacto intercambian energía hasta que su temperatura se equilibre.
El calor puede ser transferido entre objetos por diferentes mecanismos, entre los que cabe reseñar la radiación, la conducción y la convección, aunque en la mayoría de los procesos reales todos los mecanismos anteriores se encuentran presentes en mayor o menor grado.
EQUILIBIOR TERMICO
Se dice que los cuerpos en contacto térmico se encuentran en equilibrio térmico cuando no existe flujo de calor de uno hacia el otro. Esta definición requiere además que las propiedades físicas del sistema, que varían con la temperatura, también con el tiempo. Algunas propiedades físicas que varían con la temperatura son el volumen, la densidad y la presión.
El parámetro termodinámico que caracteriza el equilibrio térmico es la temperatura. Cuando dos cuerpos se encuentran en equilibrio térmico, entonces estos cuerpos tienen la misma temperatura.
En realidad, el concepto de equilibrio térmico desde el punto de vista de la Termodinámica requiere una definición más detallada que se presenta a continuación.
LEY CERO DE LA TREMODINAMICA
El equilibrio termodinámico de un sistema se define como la condición del mismo en el cual las variables empíricas usadas para definir un estado del sistema (presión, volumen, campo eléctrico, polarización, magnetización, tensión lineal, tensión superficial, entre otras) no son dependientes del tiempo. A dichas variables empíricas (experimentales) de un sistema se les conoce como coordenadas termodinámicas del sistema.
A este principio se le llama del equilibrio termodinámico. Si dos sistemas A y B están en equilibrio termodinámico, y B está en equilibrio termodinámico con un tercer sistema C, entonces A y C están a su vez en equilibrio termodinámico. Este principio es fundamental, aun siendo ampliamente aceptado, no fue formulado formalmente hasta después de haberse enunciado las otras tres leyes. De ahí que recibe la posición 0.
EQUIVALENTE MECANICO DE CALOR
En el experimento de Joule se determina el equivalente mecánico del calor, es decir, la relación entre la unidad de energía joule (julio) y la unidad de calor caloría.
Mediante esta experiencia simulada, se pretende poner de manifiesto la gran cantidad de energía que es necesario transformar en calor para elevar apreciablemente la temperatura de un volumen pequeño de agua.
Descripción.
Un recipiente aislado térmicamente contiene una cierta cantidad de agua, con un termómetro para medir su temperatura, un eje con unas paletas que se ponen en movimiento por la acción de una pesa, tal como se muestra en la figura.
La versión original del experimento, consta de dos pesas iguales que cuelgan simétricamente del eje.
La pesa, que se mueve con velocidad prácticamente constante, pierde energía potencial. Como consecuencia, el agua agitada por las paletas se clienta debido a la fricción.
Si el bloque de masa M desciende una altura h, la energía potencial disminuye en Mgh, y ésta es la energía que se utiliza para calentar el agua (se desprecian otras pérdidas).
Joule encontró que la disminución de energía potencial es proporcional al incremento de temperatura del agua. La constante de proporcionalidad (el calor específico de agua) es igual a 4.186 J/(g ºC). Por tanto, 4.186 J de energía mecánica aumentan la temperatura de 1g de agua en 1º C. Se define la caloría como 4.186 J sin referencia a la sustancia que se está calentando.
1 cal=4.186 J
En la simulación de la experiencia de Joule, se desprecia el equivalente en agua del calorímetro, del termómetro, del eje y de las paletas, la pérdida de energía por las paredes aislantes del recipiente del calorímetro y otras pérdidas debidas al rozamiento en las poleas, etc.
Sea M la masa del bloque que cuelga y h su desplazamiento vertical
m la masa de agua del calorímetro
T0 la temperatura inicial del aguay T la temperatura final
g=9.8 m/s2 la aceleración de la gravedad
La conversión de energía mecánica íntegramente en calor se expresa mediante la siguiente ecuación.
Mgh=mc(T-T0)
Se despeja el calor específico del agua que estará expresado en J/(kg K).
Como el calor especifico del agua es por definición c=1 cal/(g ºC), obtenemos la equivalencia entre las unidades de calor y de trabajo o energía.
 para producir calor, o que produce calor por procesos nucleares.
para producir calor, o que produce calor por procesos nucleares.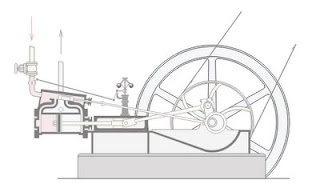
tal es el caso de la maquina de vapor que transforma la energía térmica de una cantidad de vapor de agua en energía m ecánica. En esencia, el ciclo de trabajo se realiza en dos etapas:
ecánica. En esencia, el ciclo de trabajo se realiza en dos etapas:
Se genera vapor de agua en una caldera cerrada por calentamiento, lo cual produce la expansión del volumen de un cilindro empujando un pistón. Mediante un mecanismo de biela - manivela, el movimiento lineal alternativo del pistón del cilindro se transforma en un movimiento de rotación que acciona, por ejemplo, las ruedas de una locomotora o el rotor de un generador eléctrico. Una vez alcanzado el final de carrera el émbolo retorna a su posición inicial y expulsa el vapor de agua utilizando la energía cinética de un volante de inercia.
El vapor a presión se controla mediante una serie de válvulas de entrada y salida que regulan la renovación de la carga; es decir, los flujos del vapor hacia y desde el cilindro.
MAQUINAS DE COMBUSTION INTERNA
Estas maquinas obtienen energía mecánica directamente de la energía química producida por un combustible que arde dentro de una cámara de combustión, la parte princip al de un motor. Los primeros motores de combustión interna no tenían compresión, sino funcionaron en la mezcla de aire y combustible aspirada o soplada adentro durante la primera parte del movimiento del producto. La distinción más significativa entre los motores de combustión interna modernos y los diseños antiguos es el uso de la compresión.
al de un motor. Los primeros motores de combustión interna no tenían compresión, sino funcionaron en la mezcla de aire y combustible aspirada o soplada adentro durante la primera parte del movimiento del producto. La distinción más significativa entre los motores de combustión interna modernos y los diseños antiguos es el uso de la compresión.
En este caso mostramos el MOTOR DE CUATRO TIEMPOS Se denomina ciclo, o motor de cuatro tiempos, al que precisa cuatro, o en ocasiones cinco, carreras del pistón o émbolo - dos vueltas completas del cigüeñal - para completar el ciclo termodinámico de combustión. Estos cuatro tiempos son:
Aspiración: El pistón baja y hace entrar la mezcla de aire y gasolina preparada por el carburador en la cámara de combustión.
Compresión: El émbolo comprime la mezcla inflamable. Aumenta la temperatura.
Expansión: Una chispa de la bujía inicia la explosión del gas, la presión aumenta y empuja el pistón hacia abajo. Así el gas caliente realiza un trabajo.
Expulsión: El pistón empuja los gases de combustión hacia el tubo de escape.

INTEGRANTES DEL EQUIPO:
PARA LA MATERIA DE TEMAS DE FISICA POR EL PROF. LUMBRERAS PACHECO